Über Beta-Thalassämie
Beta-Thalassämie im Überblick
Was genau sind Beta-Thalassämien?
Die Beta-Thalassämie – auch als Cooley’s Anämie bekannt – ist eine seltene, angeborene Blutkrankheit. Sie entsteht durch eine Veränderung (Mutation) in einem bestimmten Gen, das für die Herstellung von Hämoglobin verantwortlich ist. Hämoglobin ist ein lebenswichtiger Bestandteil unserer roten Blutkörperchen – es sorgt dafür, dass Sauerstoff im Körper transportiert wird.1
Bei Menschen mit Beta-Thalassämie wird Hämoglobin nicht richtig gebildet. Dadurch sind die roten Blutkörperchen oft zu klein, zu wenige und enthalten weniger Hämoglobin als nötig. Die Folge: Der Körper bekommt nicht genug Sauerstoff – das kann zu Müdigkeit, Schwäche und anderen Beschwerden führen.1
Das Wort „Thalassämie“ stammt aus dem Griechischen: thalassa bedeutet „Meer“ und aemia steht für „Blut“. Der Name wurde gewählt, weil die Krankheit ursprünglich vor allem in Ländern rund ums Mittelmeer vorkam – zum Beispiel in Griechenland oder Italien. Sie ist aber auch in Teilen Asiens, des Nahen Ostens und Afrikas verbreitet. Heute trifft man die Krankheit weltweit an – auch in Deutschland, vor allem durch Migration.1
In Deutschland leben schätzungsweise etwa 500 Menschen mit der schweren Form, der sogenannten Thalassaemia major. Weitere rund 160.000 Menschen tragen die milde Form, Thalassaemia minor. Diese Menschen haben meist keine oder nur sehr leichte Symptome, können die Genveränderung aber an ihre Kinder weitergeben.1
Wie entsteht Beta-Thalassämie?
Die Beta-Thalassämie entsteht durch eine Veränderung in den Erbanlagen (einen sogenannten Gendefekt). Diese Veränderung sorgt dafür, dass der Körper ein wichtiges Eiweiß – das sogenannte Beta-Globin – nicht richtig herstellen kann. Beta-Globin ist ein Teil des roten Blutfarbstoffs Hämoglobin, der dafür zuständig ist, Sauerstoff im Körper zu transportieren.1
Hämoglobin besteht normalerweise aus vier Eiweiß-Bausteinen – zwei Alpha-Ketten und zwei Beta-Ketten. Wenn die Beta-Ketten nicht richtig gebildet werden, funktioniert das Hämoglobin nicht mehr so, wie es sollte. Das hat Folgen:1
- Es entstehen weniger rote Blutkörperchen.
- Die roten Blutkörperchen sind kleiner als normal.
- Sie können weniger Sauerstoff transportieren.
Das führt dazu, dass der Körper schlechter mit Sauerstoff versorgt wird – was sich oft durch Müdigkeit, Blässe, Kurzatmigkeit oder allgemeine Schwäche bemerkbar macht.1

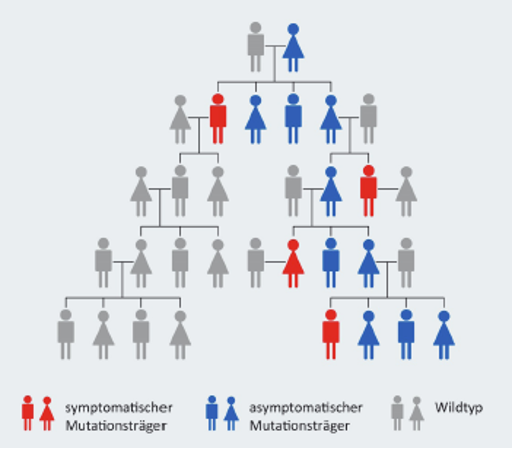
Beta-Thalassämie ist eine erblich bedingte Krankheit, das heißt: Sie wird von den Eltern an ihre Kinder weitergegeben. Die Vererbung erfolgt auf eine bestimmte Weise, die man „autosomal-rezessiv“ nennt.1
Was bedeutet das?
- Autosomal heißt: Das betroffene Gen liegt nicht auf einem Geschlechtschromosom. Deswegen können Mädchen und Jungen gleichermaßen betroffen sein.
- Rezessiv heißt: Ein Kind bekommt die Krankheit nur dann vollständig, wenn es das defekte Gen von beiden Elternteilen erbt – also von der Mutter und vom Vater. Wenn nur ein Elternteil das veränderte Gen vererbt, hat das Kind in der Regel keine Beschwerden, kann das Gen aber weitervererben – man spricht dann von einem sogenannten „Anlageträger“ (auch „Thalassaemia minor“ genannt)
Was ist Hämoglobin – und warum ist es so wichtig?
Hämoglobin ist der rote Blutfarbstoff in unseren roten Blutkörperchen. Es handelt sich um ein spezielles Eiweiß, das eine zentrale Aufgabe hat: Es transportiert Sauerstoff von der Lunge in den ganzen Körper und bringt das verbrauchte Kohlendioxid zurück zur Lunge.
Wie ist Hämoglobin aufgebaut?
Hämoglobin besteht aus zwei Hauptbestandteilen:1
- Globinketten: Das sind Eiweißbausteine, die Struktur und Funktion des Hämoglobins bestimmen. Es gibt fünf Arten davon: Alpha, Beta, Gamma, Delta und Epsilon. Ein Hämoglobin-Molekül besteht aus vier Globinketten – immer zwei gleiche Paare.
- Häm-Eisen: In jede dieser Globinketten ist ein eisenhaltiges Molekül eingebettet. Man nennt es Häm-Eisen und es ist entscheidend dafür, dass Sauerstoff gebunden und wieder abgegeben werden kann. Pro Hämoglobin-Molekül gibt es vier Häm-Eisen – also vier Sauerstoffplätze.
Welche Hämoglobin-Typen gibt es?
Im Laufe des Lebens gibt es verschiedene Formen von Hämoglobin – zwei davon sind besonders wichtig im Zusammenhang mit Beta-Thalassämie:2
- Fetales Hämoglobin (HbF): Es kommt vor allem vor der Geburt vor und besteht aus zwei Alpha- und zwei Gamma-Ketten. Nach der Geburt wird es zunehmend durch HbA ersetzt.
- Erwachsenen-Hämoglobin (HbA): Es besteht aus zwei Alpha- und zwei Beta-Ketten und übernimmt nach der Geburt die Hauptrolle im Sauerstofftransport.

Was passiert bei Beta-Thalassämie im Körper?
Beta-Thalassämie ist eine genetische Erkrankung, bei der das Erbgut für die Beta-Ketten im Hämoglobin defekt ist. Das führt zu zwei großen Problemen:
Zu wenig Beta-Ketten – zu wenig Hämoglobin
- Der Körper kann nicht genug HbA bilden.
- Es entstehen weniger und kleinere rote Blutkörperchen, die weniger Sauerstoff transportieren können.
- Die Folge: es entwickelt sich eine Blutarmut (Anämie) mit typischen Symptomen.
Überschuss an Alpha-Ketten – instabile Blutzellen
- Die Alpha-Ketten werden weiter produziert, aber wegen dem Mangel an Beta-Ketten können nur wenige HbA-Moleküle gebildet werden.
- Die überschüssigen Alpha-Ketten zerfallen schon im Knochenmark.
- Die roten Blutzellen sind dadurch instabil und werden vom Körper schnell wieder abgebaut – noch bevor sie richtig arbeiten können.
Formen der Beta-Thalassämie
Beta-Thalassämie tritt in drei verschiedenen Ausprägungen auf – je nachdem, wie stark die Bildung des roten Blutfarbstoffs gestört ist. Entscheidend ist dabei, wie viele defekte Gene vererbt wurden und wie schwerwiegend der Defekt der Gene ist.
1. Thalassaemia major – die schwere Form1
- Diese Form entsteht, wenn beide Elternteile das defekte Gen weitergeben. Man spricht dann von einer homozygoten Erkrankung.
- Ohne Behandlung ist Thalassaemia major lebensbedrohlich.
- Die Krankheit zeigt sich bereits im Säuglingsalter – mit starker Blutarmut, Wachstumsstörungen und Organschäden.
- Betroffene sind auf regelmäßige Bluttransfusionen und ärztliche Betreuung angewiesen.
2. Thalassaemia intermedia – die mittelschwere Form1
- Hier liegt entweder bei beiden Eltern weniger schwerer Defekt des betroffenen Gens vor oder jedes Elternteil hat ein unterschiedlich defektes Gen.
- Das bedeutet: Die Bildung von Hämoglobin ist zwar eingeschränkt, funktioniert aber noch teilweise.
- Die Symptome können sehr unterschiedlich ausgeprägt sein: bei einigen bereits im Kindesalter, bei anderen erst im Erwachsenenalter.
- Nicht alle Betroffenen brauchen Transfusionen – manche kommen jahrelang ohne Behandlung aus, andere benötigen gezielte medizinische Unterstützung.
3. Thalassaemia minor – die milde Form1
- Hier wird nur von einem Elternteil ein defektes Gen weitergegeben.
- Das gesunde Gen von dem anderen Elternteil reicht meist aus, um genügend HbA-Hämoglobin zu bilden.
- Diese Form verläuft oft beschwerdefrei.
- Viele Menschen wissen gar nicht, dass sie Träger*innen des Gens sind.
- Wichtig: Menschen mit Thalassaemia minor können ein defektes Gen an ihre Kinder weitergegeben werden. Deshalb ist ein Gentest bei der Familienplanung sinnvoll.
Was bei Beta-Thalassämie noch wichtig ist
Auf dieser Seite finden Sie noch weitere hilfreiche Informationen zum Thema Beta-Thalassämie. Erfahren Sie zum Beispiel wichtiges zur Diagnose der BT, welche Symptome bei BT auftreten können oder welche Therapieoptionen infrage kommen.
- Cario H. Beta (ß) –Thalassämie. 2023. online verfügbar unter: https://www.kinderblutkrankheiten.de/sites/gpoh/kinderkrebsinfo/kinderblutkrankheiten/content/e97222/e96941/e96942/e104986/e106654/ss_Thalassaemie.pdf (Zuletzt aufgerufen März 2025).
- Thieme via medici. Hämoglobin Synthese und Aufbau. 2025. Online verfügbar unter https://viamedici.thieme.de/lernmodul/549519/539519/ (Zuletzt aufgerufen März 2025).
Symptome
So zeigt sich die Beta-Thalassämie
Die Beta-Thalassämie ist eine Erkrankung, die je nach Form unterschiedlich schwer verlaufen kann. Manche Menschen haben kaum Beschwerden, während andere mit schweren Symptomen zu kämpfen haben. Die wichtigsten Informationen zu den verschiedenen Symptomen sind hier zusammengefasst.
Thalassaemia major
Diese Form der Krankheit muss zwingend behandelt werden, da sie sonst schon im frühen Alter lebensbedrohlich ist. Sie zeigt sich meist bereits im ersten Lebensjahr durch eine ausgeprägte Blutarmut.1
Zu den typischen Symptomen der Blutarmut gehören:1
- Blässe
- Müdigkeit und Antriebslosigkeit
- Atemnot bei körperlicher Belastung
- schneller Herzschlag
- Appetitlosigkeit und Trinkunlust
- Entwicklungsstörungen
- Vergrößerung von Leber und Milz
Der Körper versucht zunächst den Mangel an funktionierenden roten Blutkörperchen durch eine Steigerung der Blutproduktion auszugleichen. Dazu steigert er die Aufnahme von Eisen aus der Nahrung. Allerdings kann das zusätzliche Eisen nicht verwertet werden und wird in bestimmten Organen abgelagert. Es kommt zu einer sogenannten Eisenüberladung, die zu folgenden Symptomen führen kann:1
- Herzmuskelschwäche und Herzrhythmusstörungen
- Leberfunktionsstörungen
- Schilddrüsenfunktionsstörungen
- Störungen des Vitamin-D-Haushalts
Parallel zur Eisenaufnahme wird auch die Blutbildung im Knochenmark hochgefahren. Das Knochenmark wächst dabei immens, was dazu führt, dass sich die Knochen verformen und brüchig werden können. Man sprich hier vom Osteopenie-Osteoporose-Syndrom. Es geht mit folgenden Symptomen einher:1
- Veränderung der Knochen von Schädel und Gesicht
- Verformung von Rippen und Wirbelkörpern
- Knochenschmerzen
- Erhöhtes Risiko für Knochenbrüche
Wenn die Erkrankung nicht behandelt wird, muss die Milz auf Hochtouren laufen, um die zahlreichen defekten roten Blutkörpcherchen abzubauen. Es kommt zu einer krankhaften Vergrößerung der Milz (Hypersplenie-Syndrom).1 Außerdem beginnt die Milz ebenfalls, rote Blutkörperchen herzustellen, doch auch diese sind fehlerhaft und müssen direkt wieder abgebaut werden. Die krankhaft vergrößerte Milz baut immer mehr Blutkörperchen ab – sowohl rote als auch weiße. Das verschlimmert die Blutarmut und schwächt die Funktion des Immunsystems.1
Gut zu wissen: Da die major-Form der Beta-Thalassämie heute in der Regel früh erkannt und behandelt wird, kommt es nur noch selten zur vollen Ausprägung der genannten Symptome.1
Thalassaemia intermedia
Bei dieser Form treten die Symptome meist später auf als bei der major-Form. Bei einigen Betroffenen schon im Kleinkindalter, bei anderen erst im Erwachsenenalter. Typische Anzeichen sind ähnlich wie bei der major-Form, können aber weniger schwer sein.1
Zusätzlich können folgende Komplikationen auftreten:1
- Zunehmende Blutarmut
- Zeichen krankhaft gesteigerter Blutbildung
- Gefühlsstörungen oder Lähmungen in Armen und Beinen
- Neigung zu Blutgerinnseln
- Gallensteine
- Unterschenkelgeschwüre
Thalassaemia minor
Diese Form verläuft in den meisten Fällen unauffällig. Die Mehrheit der Betroffenen hat keine gesundheitlichen Probleme.1 Bei etwa einer von fünf Personen können jedoch leichte Anzeichen einer Blutarmut auftreten, wie schnelle Erschöpfbarkeit und Müdigkeit.1 Bei Schwangeren, oder auch bei Kindern und Jugendlichen kann durch Wachstumsschübe ein Eisenmangel entstehen, der die Beschwerden verstärken kann.1
- Cario H. Beta (ß) –Thalassämie. 2023, online verfügbar unter: https://www.kinderblutkrankheiten.de/sites/gpoh/kinderkrebsinfo/kinderblutkrankheiten/content/e97222/e96941/e96942/e104986/e106654/ss_Thalassaemie.pdf (Zuletzt aufgerufen März 2025).
Diagnose
Wie wird die Beta-Thalassämie diagnostiziert?
Je nachdem, welche Form der Beta-Thalassämie vorliegt, kann es leichter oder schwerer sein, diese zu erkennen. Bei der schweren Form (Thalassaemia major) sind die Krankheitszeichen in der Regel schon in frühester Kindheit so schwer, dass man die Erkrankung kaum übersehen kann.1 Bei der Thalassämia intermedia sind sie oft milder und treten später auf.1 Die minor-Form kann sogar komplett symptomfrei sein.2 In der Regel gibt es zunächst einen Verdacht auf Beta-Thalassämie, der sich an bestimmten Kennzeichen festmacht. Wenn dieser Verdacht aufkommt, werden dann weitere Untersuchungen durchgeführt, um die Verdachtsdiagnose bestätigen oder widerlegen zu können.
Verdacht auf Beta-Thalassämie
Der Verdacht auf eine Beta-Thalassämie ergibt sich oft aus der Krankengeschichte (Anamnese) und einer körperlichen Untersuchung. Typische Verdachts-Symptome sind:2
- Blässe und rasche Ermüdung
- Wachstumsverzögerungen
- Geschwollener Unterleib
Vor allem bei Betroffenen, mit genetischer Herkunft aus dem Mittelmeerraum sowie dem Mittleren und Nahen Osten, Asien oder Afrika können diese Beschwerden den Verdacht auf eine Beta-Thalassämie wecken.3
Darauf folgen zusätzliche Untersuchungen.
Untersuchungen zur Sicherung der Diagnose Beta-Thalassämie
Mit den folgenden Untersuchungen kann die Verdachtsdiagnose bestätigt oder widerlegt werden. Für diese Untersuchungen wird etwas Blut entnommen und untersucht:2,3
- Blutbild: Dabei werden Anzahl, Größe und Gehalt an rotem Blutfarbstoff (Hämoglobin) der roten Blutkörperchen bestimmt. Bei einer Beta-Thalassämie ist die Anzahl verringert und die Blutkörperchen sind kleiner und enthalten weniger Hämoglobin.
- Blutausstrich: Dabei wird eine Blutprobe unter dem Mikroskop untersucht. Bei einer Beta-Thalassämie zeigen sich dabei für die roten Blutkörperchen dieselben Veränderungen wie beim Blutbild (weniger, kleiner, blasser). Zusätzlich kann man hier erkennen, ob die roten Blutkörperchen verformt sind, was auch ein typisches Zeichen der Beta-Thalassämie sein kann.
- Hämoglobinanalyse: Mit dieser Untersuchung werden die verschiedenen Arten von Hämoglobin in den roten Blutkörperchen untersucht. Bei Beta-Thalassämie ist deutlich weniger “adultes Hämoglobin” (HbA) vorhanden als bei Gesunden.
- Eisengehalt: Die Menge an Eisen im Blut wird bestimmt. Bei Menschen mit Beta-Thalassämie ist sie oft erhöht, da ihre roten Blutkörperchen schneller abgebaut werden und dabei Eisen ins Blut freigesetzt wird.
- Genetische Untersuchung: Damit erfolgt der genetische Nachweis einer Beta-Thalassämie. Man untersucht das Gen, welches für die Produktion der beta-Globinketten verantwortlich ist – das HBB-Gen. Findet sich dort ein Fehler (Mutation) ist das der Beweis für die Erkrankung.
Familienuntersuchung
Bei einem bestätigten Fall von Beta-Thalassämie, kann eine Familienuntersuchung sinnvoll sein, da die Erkrankung vererbt wird und die minor-Form symptomfrei sein kann.2
Dazu werden bei beiden Eltern Blutbild, Hämoglobinanalyse und eine genetische Untersuchung durchgeführt. Das ist wichtig für eine eventuelle genetische Beratung, wenn die erkrankte Person zum Beispiel plant, selbst Kinder zu haben.2
Ergänzende Untersuchungen im Krankheitsverlauf
Wenn eine Beta-Thalassämie diagnostiziert wurde, können im Verlauf der Erkrankung weitere Untersuchungen notwendig sein. Diese helfen zum Beispiel dabei, mögliche Komplikationen frühzeitig zu erkennen oder ihnen sogar vorzubeugen. Die Untersuchungen werden üblicherweise in Spezialzentren für Blutkrankheiten durchgeführt:2
- Körperliche Untersuchung: Vor allem bei Kindern und Jugendlichen werden Wachstum und die körperliche Entwicklung regelmäßig (ca. Alle 3 Monate) untersucht.
- Blutuntersuchung: Um den Verlauf der Blutarmut zu dokumentieren und mögliche Komplikationen frühzeitig zu erkennen (z. B. zu hohe Eisenwerte).
- Bestimmung der Blutgruppe: Wichtig, falls Bluttransfusionen zur Behandlung notwendig sind.
- HLA-Typisierung: Bestimmung der sogenannten Gewebeverträglichkeit. Dies muss vor einer eventuellen Stammzelltransplantation erfolgen, um passende Spender suchen zu können.
- Ultraschalluntersuchung von Herz und Leber: Wird durchgeführt, um mögliche Komplikationen durch zu hohen Eisenwerte frühzeitig zu erkennen.
- Weitere Untersuchungen des Herzens: Zur Überwachung der Herzfunktion können Untersuchungen wie Elektropkardiographie (EKG) eingesetzt werden.
- Röntgenuntersuchung: Wichtig, um mögliche Veränderungen an den Knochen zu erkennen.
Gut zu wissen: nicht jede der hier genannten Untersuchungen ist bei jedem Betroffenen notwendig. Welche Untersuchungen sinnvoll sind, sollte im Rahmen der ärztlichen Beratung geklärt werden.
- Beta Thalassaemia – Diagnosis. National Organization for Rare Disorders. online verfügbar unter: https://rarediseases.org/rare-diseases/thalassemia-major/#diagnosis (Zuletzt aufgerufen März 2025).
- Cario H. Beta (ß) –Thalassämie. 2023, online verfügbar unter: https://www.kinderblutkrankheiten.de/sites/gpoh/kinderkrebsinfo/kinderblutkrankheiten/content/e97222/e96941/e96942/e104986/e106654/ss_Thalassaemie.pdf (Zuletzt aufgerufen März 2025).
- Onkopedia Leitlinien. Beta Thalassämie. 2022. Online verfügbar unter: https://www.onkopedia.com/de/onkopedia/guidelines/beta-thalassaemie/@@guideline/html/index.html#ID0EUPAC (Zuletzt aufgerufen März 2025).
Verlauf und Prognose
So verläuft die Beta-Thalassämie
Der Verlauf der Beta-Thalassämie hängt stark von der jeweils vorliegenden Form der Erkrankung und von der individuellen Situation der Betroffenen ab.
Thalassaemia major
Dank verbesserter und neuer Therapien hat sich die Prognose für Menschen mit Beta-Thalassämie deutlich verbessert. Viele Betroffene können heute bei guter Behandlung das Rentenalter erreichen. Damit wird auch die Lebensqualität im Alltag immer wichtiger. Voraussetzung ist ein frühzeitiger Start der Therapie und eine kontinuierliche Betreuung in einem spezialisierten Zentrum – auch im Erwachsenenalter.1
Thalassaemia intermedia
Es gibt zwar keine exakten Daten zu dieser Patientengruppe, aber Fachleute gehen davon aus, dass sich hier vergleichbare Effekte wie bei Menschen mit Thalassaemia major zeigen.1
Thalassaemia minor
Auch hier gibt es kaum genaue Daten. Da diese Form der Krankheit wenige bis keine Beschwerden verursacht geht man im Allgemeinen davon aus, dass Betroffene eine gute Prognose haben.1
- Cario H. Beta (ß) –Thalassämie. 2023, online verfügbar unter: https://www.kinderblutkrankheiten.de/sites/gpoh/kinderkrebsinfo/kinderblutkrankheiten/content/e97222/e96941/e96942/e104986/e106654/ss_Thalassaemie.pdf (Zuletzt abgerufen März 2025).
Therapie
Welche Behandlungsmöglichkeiten für Beta-Thalassämie gibt es?
Die Behandlung der Beta-Thalassämie erfolgt üblicherweise in einem spezialisierten Behandlungszentrum durch ein Team aus verschiedenen Fachleuten. Dadurch kann der Krankheitsverlauf gut überwacht und Komplikationen frühzeitig erkannt werden.
Vor allem Menschen mit Thalassämie major und intermedia benötigen eine Behandlung, da diese Formen der Krankheit ohne Therapie schnell lebensbedrohlich werden können.
Man unterscheidet bei der Therapie grundlegend nach symptomatischen und kurativen Behandlungen.1
- Symptomatische Therapien sollen die von der Krankheit verursachten gesundheitlichen Probleme (z. B. Blutarmut) lindern und Komplikationen vermeiden. Sie müssen dafür regelmäßig angewendet werden.
- Kurative Therapien zielen auf eine dauerhafte Heilung oder die Behandlung der Krankheitsursachen ab.
Symptomatische Therapie
Bluttransfusion
Die häufigste symptomatische Maßnahme ist die Transfusionsbehandlung. Eine Transfusionsbehandlung wird empfohlen, wenn die Hämoglobin-Konzentration wiederholt unter einen bestimmten Wert fällt oder sich bestimmte Anämie-Symptome zeigen.1,2
Wie häufig die Transfusionen erfolgen und wieviel Blut übertragen wird, hängt von Faktoren wie Alter, Körpergewicht und dem Hämoglobinwert der Patient*innen ab. Die Therapie wird daher regelmäßig auf Basis der individuellen Patientensituation angepasst.1
Die Ziele der Transfusionsbehandlung sind:1,2
- Reduzierung der Anämie
- Unterdrückung der ineffizienten Blutbildung
- Verbesserung des Allgemeinbefindens
- Verhinderung von Skelettveränderungen
- Sicherstellung eines normalen Körperwachstums
- Verringerung des Thromboserisikos
- Normalisierung der Eisenaufnahme im Darm
Trotz ihrer Vorteile birgt die Transfusionsbehandlung auch Risiken. Hier sind vor allem Abwehrreaktionen des Immunsystems zu nennen, die zu Beschweren wie Fieber, allergischen Reaktionen oder einem schnellen Abbau der Blutzellen führen können. Theoretisch können mit einer Bluttransfusion auch Infektionskrankheiten wie Hepatitis oder HIV übertragen werden. Dies kommt in Deutschland jedoch nur extrem selten vor.1
Chelattherapie
Durch die Kombination aus erhöhter Eisenaufnahme aus der Nahrung und regelmäßigen Bluttransfusionen kann es bei Menschen mit Thalassämie major und solchen mit transfusionspflichtiger Thalassämie intermedia zu einer Eisenüberladung in Organen wie Herz und Leber kommen.
Um dies zu behandeln, wird eine sogenannte Chelattherapie eingesetzt. Dabei binden Medikamente (Chelatoren) das überschüssige Eisen und ermöglichen dessen Ausscheidung. Die Chelatoren werden entweder im Krankenhaus unter die Haut (subkutan) gespritzt oder zu Hause in Tablettenform verabreicht. Ob und wann eine Chelattherapie notwendig ist, hängt vom Eisengehalt in Blut und Leber ab.1
Milzentfernung (Splenektomie)
Die Splenektomie ist die chirurgische Entfernung der Milz und kann bei Beta-Thalassämie notwendig werden, wenn die Milz überaktiv wird und zu viele gesunde Blutzellen abbaut. Ziel ist es, den Transfusionsbedarf zu senken, die Eisenüberladung zu reduzieren und Infektionen zu verringern. Allerdings erhöht sich nach der OP das Risiko für schwere Infektionen und Thrombosen. Daher sind Impfungen, Antibiotikaprophylaxe und regelmäßige ärztliche Kontrollen wichtig, um Komplikationen zu vermeiden.1
Behandlung von Folgeerkrankungen
Beta-Thalassämie kann verschiedene Folgeerkrankungen mit sich bringen. Hier sind vor allem Herzerkrankungen sowie Knochenerkrankungen (Osteopenie-Osteoporose-Syndrom) zu nennen.1 Ursachen sind meist die übersteigerte Blutbildung und die Eisenüberladung. Durch die individuelle Einstellung von Transfusionstherapie und Chelattherapie können diese Komplikationen in der Regel vermieden oder zumindest verringert werden. Zusätzlich werden Lebensstilmaßnahmen empfohlen, zu denen körperliche Aktivität und eine kalziumreiche Ernährung, aber auch die Vermeidung von Risikofaktoren (Rauchen) gehören.1,2
Kurative Therapie
Stammzelltransplantation
Die Stammzelltransplantation (SZT) gilt als heilende Therapie für Beta-Thalassämie. Dabei werden die krankhaften Blutstammzellen im Knochenmark zerstört (z. B. durch eine Chemotherapie) und danach durch Stammzellen eines gesunden Spenders ersetzt. Diese gesunden Stammzellen können sich im Körper ansiedeln und anschließend neue, funktionstüchtige Blutzellen bilden.1
Voraussetzung für eine erfolgreiche Transplantation ist ein*e HLA-identischer Spender*in. HLA (Humane Leukozyten-Antigene) sind spezielle „Merkmale“ auf den Zellen unseres Körpers, die dem Immunsystem helfen, zwischen eigenen und fremden Zellen zu unterscheiden. Um eine möglichst hohe Erfolgswahrscheinlichkeit der Stammzelltransplantation zu ermöglichen, versucht man Spender*innen zu finden, deren HLA-Merkmale so gut wie möglich mit denen der Empfänger*innen übereinstimmen. Man untersucht dabei zunächst Geschwister, weil diese eine höhere Chance auf Übereinstimmung haben. Kommt ein Geschwisterkind nicht als Spender*in infrage beginnt man mit der Suche nach fremden Spender*innen.
Da eine SZT ein sehr massiver Eingriff ist und die Chemotherapie den Körper extrem belastet, muss sorgfältig abgewogen werden, ob sie im individuellen Fall angemessen ist. Üblicherweise wird sie nur Patient*innen empfohlen, die unter der Thalassaemia major-Form leiden und einen HLA-identischen, verwandten Spender haben.1
Aufgrund des steigenden Risikos von Komplikationen mit zunehmendem Alter wird die Transplantation möglichst im frühen Kindesalter durchgeführt.3
Gentherapie
Ein recht neuer Ansatz ist die Gentherapie. Bei dieser Behandlung versucht man, genetisches Material direkt in die betroffenen Zellen einzuschleusen. So soll zum Beispiel ein defektes oder fehlendes Gen ersetzt, abgeschaltet oder reguliert werden. Die Grundidee kann folgendermaßen beschrieben werden: man entnimmt den Betroffenen Blutstammzellen. Diese werden dann im Labor gentechnisch behandelt. Dann zerstört man – ähnlich wie bei der Stammzellspende – die erkrankten Stammzellen im Körper durch eine Chemotherapie. Danach werden die gentechnisch behandelten Stammzellen über eine Infusion in den Körper zurückgeführt und können sich dort ansiedeln und das Knochenmark wiederherstellen.1
Vorteile gegenüber der Stammzelltherapie sind, dass man keine*n Spender*in benötigt und dass es bei der durch die Benutzung körpereigener Stammzellen zu keiner Abstoßungsreaktion kommt.1
Allerdings konnte in bisherigen Anwendungen nicht immer eine komplette Heilung erzielt werden, zumindest aber eine Reduzierung des Transfusionsbedarfs. Zudem sind die Behandlungen sehr teuer und kommen nicht für alle Betroffenen infrage.1
Aktuell gibt es zwei Arten von Gentherapien:
- Additive Gentherapie: Mithilfe eines gentechnisch veränderten Virus wird eine gesunde Kopie des HBB-Gens in die Stammzellen eingebracht. Diese Behandlung ist aktuell in der EU nicht verfügbar, da die Herstellerfirma das Produkt aus ökonomischen Gründen vom Markt genommen hat.1,2
- Gen-Editierung: Hier wird eine sogenannte Genschere (CRISPR/Cas9) benutzt, um das Erbgut der Stammzellen gezielt zu verändert. Dabei wird ein „Stopp-Signal“ abgeschaltet, welches nach der Geburt die Produktion des fetalen Hämoglobins (HbF) unterdrückt. Durch Reaktivierung der Produktion von HbF soll die mangelhafte Produktion des adulten Hämoglobins ausgeglichen werden. Ein entsprechendes Produkt ist seit 2024 in der EU zugelassen.1,4
Behandlung mit Lusatercept
Der Wirkstoff Luspatercept ist seit 2020 in Deutschland für Erwachsene zugelassen. Er fördert die Reifung roter Blutkörperchen. Ziel der Behandlung ist es, die Menge an funktionstüchtigen roten Blutkörperchen zu erhöhen. Patient*innen mit transfusionsabhängiger Beta-Thalassämie benötigen durch die Behandlung dann seltener Bluttransfusionen.1,2
- Cario H. Beta (ß) –Thalassämie. 2023, online verfügbar unter: https://www.kinderblutkrankheiten.de/sites/gpoh/kinderkrebsinfo/kinderblutkrankheiten/content/e97222/e96941/e96942/e104986/e106654/ss_Thalassaemie.pdf (Zuletzt aufgerufen März 2025).
- Beta Thalassämie (Stand Mai 2022). Onkopedia Leitlinien. Online verfügbar unter: https://www.onkopedia.com/de/onkopedia/guidelines/beta-thalassaemie/@@guideline/html/index.html#ID0ER5AE (Zuletzt aufgerufen März 2025).
- Gesellschaft für Pädiatrische Onkologie und Hämatologie und Gesellschaft für Kinder- und Jugendmedizin. Thalassämien S1-Leitlinie. AWMF Register Nr. 025/017. Version 6. Stand 02.2023. online verfügbar unter: https://register.awmf.org/assets/guidelines/025
- Casgevy (Exagamglogene autotemcel). European Medicines Agency. Stand 12.2023. online verfügbar unter: https://www.ema.europa.eu/en/medicines/human/EPAR/casgevy (Zuletzt aufgerufen März 2025).